COMBINACIONES QUÍMICAS
Óxidos: Son compuestos binarios formados por
combinación del oxígeno en su número de oxidación –2, con otro elemento, que
llamaremos E, actuando con valencia (n) positiva. (La valencia de un elemento
es el número de oxidación, sin signo). Su fórmula general es:
E2On
Los subíndices se
obtienen al intercambiar las valencias de ambos elementos, e indican el número
de veces que ese elemento está presente en el compuesto.
La forma más simple
de formular un óxido es a partir de sus elementos, conociendo el número de
oxidación con el que están actuando. Para el oxígeno es, en este tipo de
compuestos, siempre -2; solo resta entonces conocer el del segundo elemento.
Más adelante veremos otra forma de obtener los óxidos, partiendo de los
elementos y usando reacciones químicas.
Ejemplos de
formulación de óxidos:
Li+ y O2- Li2O
Fe3+ y O2- Fe2O3
Cuando ambos números
de oxidación son pares (+2, +4, +6) se simplifican para llegar a la fórmula del
óxido:
Ca2+ y O2- Ca2O2 CaO
Pb4+ y O2- Pb2O4 PbO2
Mn6+ y O2- Mn2O6 MnO3
Nomenclatura: Como ya
te contamos, existen varias formas de nombrar los compuestos químicos, algunas
nuevas, como las recomendadas por la IUPAC, y otras más antiguas. Dado que
podes encontrarte con todas ellas, es importante que las conozcas para que
puedas trabajar mejor y comprender los textos de estudio, así como también los
problemas.
1) Nomenclatura por
Atomicidad: Utiliza prefijos para cada elemento que indica la
cantidad de veces que están en ese compuesto.
Ejemplo para el caso
de los óxidos:
Li2O Dióxido de litio
Fe2O3 Trióxido de dihierro
CaO Monóxido de calcio
PbO2 Dióxido de plomo
MnO3 Trióxido de manganeso
2) Nomenclatura por
Numerales de Stock: Se indica primero el tipo de compuesto y a
continuación el elemento principal con su valencia entre paréntesis y en
números romanos.
Ejemplo para el caso
de los óxidos:
Li2O Oxido de litio (I)
Fe2O3 Oxido de hierro (III)
CaO Oxido de calcio (II)
PbO2 Oxido de plomo (IV)
MnO3 Oxido de manganeso (VI)
Cuando el elemento
principal tiene una sola valencia, puede no indicarse la misma, ya que solo
existe una posibilidad de formar el compuesto, pero nunca puede omitirse si
tiene más de una, pues es la forma en que se diferencian los distintos compuesto
que forma ese elemento.
3) Nomenclatura
tradicional: se indica primero el tipo de compuesto químico, y luego
se usan diferentes terminaciones e incluso prefijos, para hacer referencia al
número de oxidación del elemento principal.
Cuando el elemento
posee una única valencia, se añade la terminación “ico”.
Ejemplo:
CaO Oxido cálcico
Cuando el elemento
posee dos valencias, se añade la terminación “ico”a la mayor y “oso” a la menor.
Ejemplo:
PbO Oxido plumboso
PbO2 Oxido plúmbico
Cuando el elemento
posee tres valencias, se añade la terminación “oso” a la menor de
ellas, “ico” a la siguiente y a la mayor se la indica
con el prefijo “per” y la terminación “ico”. Ejemplo:
CrO Oxido cromoso
Cr2O3 Oxido crómico
CrO3 Oxido percrómico
Cuando el elemento
posee cuatro valencias, se indican, la menor de todas con el prefijo “hipo” y la terminación “oso”, la siguiente en
orden creciente por la terminación “oso”, la tercera por la terminación “ico” y la mayor con el
prefijo “per” y la terminación “ico”. Ejemplo:
Cl2O Oxido hipocloroso
Cl2O3 Oxido cloroso
Cl2O5 Oxido clórico
Cl2O7 Oxido perclórico
Acordate que podes
encontrar las tres nomenclaturas en los libros, los problemas, etc. y que se
acepta el uso de todas, aunque se prefiere el de aquellas recomendadas por la
IUPAC. Pero que no se deben mezclar dos nomenclaturas distintas en un
mismo compuesto. Por ejemplo:
Fe2O3
Se puede nombrar como
trióxido de dihierro o como óxido de hierro (III), pero nunca trióxido de
hierro (III) o trióxido férrico.
Comparemos las tres
nomenclaturas para una misma serie de óxidos:
Fórmula Nomenclatura Tradicional
Nomenclatura por atomicidad
Nomenclatura por Numerales de Stocks
Cl2O Oxido hipocloroso Monóxido de dicloro
Oxido de cloro (I)
Cl2O3 Oxido cloroso Trióxido de dicloro
Oxido de cloro (III)
Cl2O5 Oxido clórico Pentóxido de dicloro
Oxido de cloro (V)
Cl2O7 Oxido perclórico Heptóxido de dicloro
Oxido de cloro (VII)
Ya estás en
condiciones de realizar algunos ejercicios prácticos de formulación y
nomenclatura de óxidos, luego veremos un poco más sobre estos compuestos. A
trabajar.
Ejercicio 1: Escribí la fórmula de los óxidos que forman los siguientes
iones:
Mg (II) / Ag (I) / Pb (IV) / Br (I) / Cl (III) / Zn (II) / Fe (III)
Cu (II) / I (VII) / Br (V) / S (VI)
Ejercicio 2: Nombrá los óxidos que obtuviste en el ejercicio anterior por,
al menos dos nomenclaturas distintas.
Ejercicio 3: Escribí la fórmula correspondiente, indicando el número de
oxidación en que actúa cada elemento:
a)
Óxido hipoiodoso
b)
Óxido de cadmio
c)
Óxido fosforoso
d)
Monóxido de dilitio
e)
Óxido potásico
f)
Óxido de estaño (IV)
g)
Dióxido de carbono
h)
Óxido de plomo (II)
i)
Heptóxido de dibromo
j)
Óxido de cromo (VI)
Ejercicio 4: Nombra, de todos las formas posibles, los siguientes
compuestos:Au2O3 / P2O5 / NiO / Hg2O / BaO / Bi2O3 / Bi2O5 / Sb2O3 / As2O5 /SO3 / SrO / CoO / CaO / Co2O3 / SeO2
En los ejercicios
anteriores, habrás notado que el oxígeno se combinaba con diferentes tipos de
elementos. Esto determina el tipo de óxido formado, y otras particularidades,
como su comportamiento frente al agua y el tipo de compuesto que forman en este
caso.
Existen cuatro clases de óxidos:
Óxidos Básicos: son los que se
forman por combinación del oxígeno con un elemento metálico y al disolverse en
agua, producen otro tipo de compuestos, los Hidróxidos, que estudiaremos más
adelante.
Óxidos Ácidos: se forman por
combinación del oxígeno con elementos no metálicos y forman, al
disolverse en agua, otra clase de compuestos llamados
Oxoácidos. También
los estudiaremos más adelante.
Óxidos Neutros: son aquellos que se
forman por combinación del oxígeno con metales y no metales, que al mezclarse
con el agua no reaccionan, por lo que no forman ni hidróxidos ni oxoácidos.
Óxidos Anfóteros: se obtienen por
combinación del oxígeno con elementos como Al, Be, Zn, Ga, Sn y Pb entre otros,
y según el medio en el que se encuentren, formarán hidróxidos u oxoácidos.
Pero, ¿cómo se forman
realmente los óxidos? Hasta ahora, los hemos obtenido directamente con los
elementos y conociendo el número de oxidación en que estos actuaban. Vamos a
ver a continuación, como se forman realmente, desde su reacción química. Para
esto debemos entender primero qué es una reacción química.
Una reacción química
es el proceso por el cual una o más
sustancias cambian para formar una o más sustancias nuevas. Las reacciones
químicas se representan por medio de ecuaciones químicas.
Vamos a tratar de aprenderlo usando los óxidos que
formulamos antes como ejemplo.
Dijimos que los
óxidos se forman a partir de sus elementos (los elementos tienen n° de
oxidación cero). Así, el óxido de litio se forma a partir de: Li (s) + O2 (g) Li2O (s)
El signo “+” se interpreta como “se combina con”
y la “flecha” se interpreta como “para formar”. Todas las
sustancias que están a la izquierda de la flecha se llaman “reactivos”, las que están a la
derecha se llaman “productos”. Entonces, vemos que “los reactivos
se combinan para formar productos”. Pero toda reacción química es también una
ecuación, y como tal debe resolverse. Si la flecha ocupa aquí, el lugar del
signo igual Li (s) + O2 (g) = Li2O (s)
Esto significa que “todos los
elementos que están como reactivos deben estar también entre los productos”, y deben estarlo “en la misma
cantidad” a ambos lados del signo
igual. Esto es cierto además, porque los átomos no se crean ni se destruyen, por lo
tanto, una ecuación química deberá tener el mismo número de átomos de cada tipo a
cada lado de la flecha, tiene que haber un equilibrio o balance de los
elementos. Debemos balancear la ecuación. Para ello usaremos números enteros
multiplicando a cada compuesto, de forma tal que el número de átomos de cada tipo
sea el mismo a ambos lados de la flecha. Estos números se llaman coeficientes
estequiométricos.
Para nuestro ejemplo,
hay un átomo de Li entre los reactivos y dos entre los productos, mientras que
para el O la relación es inversa. ¿por qué número deberé multiplicar al Li y/o
al O para igualar la ecuación? Si comenzamos por el Li, podría multiplicar el
elemento Li (en los reactivos) por 2, con eso estaría balanceado:
2Li (s) + O2 (g) Li2O (s)
Si a continuación
quiero balancear el O, también tendría que multiplicar el óxido por 2, pero
esto produce un desbalance del Li.
2Li (s) + O2 (g) 2 Li2O (s)
Tengo que empezar de
nuevo, esta vez comenzando por balancear el O. Si multiplico el óxido por 2,
este elemento queda igualado y ahora tengo 4 átomos de Li entre los productos, Li
(s) + O2 (g) 2 Li2O (s)
Como solo hay un
átomo de Li en los reactivos, simplemente lo multiplico por 4.
4 Li (s) + O2 (g) 2 Li2O (s)
La ecuación ya está
balanceada. Si ahora la leemos, dice que “4 átomos de Li se combinan con dos moléculas
de Oxígeno para formar 2 fórmulas unidad de óxido de litio”. (¿Notaste que al
hablar de Oxígeno lo llamamos “molécula”, al Litio
“átomo” y al óxido
“fórmula unidad”? Es porque los átomos de oxígeno están unidos formando una
molécula, un compuesto de estructura definida: 2 átomos de
O, unidos por un tipo
de enlace llamado covalente; el Litio es un metal, con una estructura diferente
y el óxido es un compuesto formado por iones, también en una estructura
definida, pero con un enlace llamado iónico. Los tipos de enlace los vamos a
estudiar durante el cursado de Química General e Inorgánica).
En realidad no es
difícil, solamente es un problema de prueba y error, pero con suficiente
práctica, vas a ver que no es tan difícil.
Es muy importante que
recuerdes:
Solo se pueden
modificar los coeficientes, pero nunca los subíndices. Si cambio un
coeficiente, solo varía la “cantidad” de veces que “ese” compuesto está
presente en la reacción. Pero al cambiar un subíndice, cambia la “identidad”
del compuesto.
Las letras entre
paréntesis a la derecha de cada compuesto indican su estado de agregación, es
decir, si son sólidos (s), líquidos (l), gaseosos (g) o acuosos (ac). Siempre
acompañan a los compuestos químicos en una reacción y a veces, permiten
diferenciar entre dos compuestos con la misma fórmula y distintas
características (hidruros e hidrácidos).
Aclaración: si bien
podemos plantear una reacción de obtención para todos los compuestos, no
necesariamente esta sea la vía por la que se forman en la naturaleza,
simplemente la planteamos con fines didácticos, para que te sea más simple
entender el proceso, así como también, que puedas practicar un poco más.
Ahora estás
nuevamente en condiciones de realizar solo algunos ejercicios.
Ejercicio 5: ¿Te animás a escribir la
reacción de formación de los óxidos que obtuviste en los ejercicios anteriores?
Hidróxidos: son compuestos formados por la combinación
del grupo hidroxilo u oxidrilo (OH-) y un catión,
generalmente metálico. El grupo OH– es un ión poliatómico
con carga negativa –1, y a los efectos de la nomenclatura, se lo trata como si
fuera un solo elemento con número de oxidación –1. Por esto los hidróxidos son
considerados compuestos seudobinarios.
Su fórmula genérica
es:
Me(OH)n
Donde Me es el catión
y el subíndice “n” es su valencia. Ésta siempre se escribe fuera de un
paréntesis que incluye al oxidrilo, porque significa que multiplica los dos
elementos que lo componen, y se interpreta como el número de oxidrilos necesarios
para neutralizar la carga de ese catión. El subíndice del catión siempre es 1
(no se escribe) por lo que dijimos antes respecto a la carga del oxidrilo.
Para formularlos,
nuevamente la manera más simple es partir desde el catión y el oxidrilo, ambos
con su número de oxidación. Por ejemplo:
Na+ (ac) y OH– (ac) NaOH (ac)
Mg2+ (ac) y OH– (ac) Mg(OH)2 (ac)
Al3+ (ac) y OH– (ac) Al(OH)3 (ac)
Para nombrarlos, se
puede usar la nomenclatura tradicional, indicando que el tipo de compuesto es
un “hidróxido” y usando las terminaciones
adecuadas, según las mismas reglas que los óxidos; o referirlo
como “hidróxido de” seguido del nombre del
catión. Cuando el catión es un metal, se agrega su número de
oxidación entre paréntesis y en números romanos. En el caso de nuestros ejemplos,
sería: NaOH Hidróxido sódico o Hidróxido de Sodio
(I) Mg(OH)2 Hidróxido magnésico o
Hidróxido de Magnesio (II) Al(OH)3 Hidróxido alumínico o Hidróxido de Aluminio (III)
Cuando el elemento
presenta un único número de oxidación se acepta que no se indique el mismo,
pues se supone conocido.
Ahora, es tu turno de
trabajar, pues ya estás en condiciones de formular y nombrar este nuevo tipo de
compuesto químico. Luego veremos cómo se obtienen a partir de las reacciones
químicas.
Ejercicio 6: Formular los hidróxidos de
los siguientes iones:
Mg (II) / Ag (I) / Pb (IV) /
Zn (II) / Fe (III) / Cu (I) / Au (III)
Li (I) / Sn (IV) / Ba (II) / Ni (III)
Ejercicio 7: escribí la fórmula de los
siguientes hidróxidos:
a)
Hidróxido de potasio
b)
Hidróxido cálcico
c)
Hidróxido ferroso
d)
Hidróxido de sodio
e)
Hidróxido de zinc
f)
Hidróxido cúprico
g)
Hidróxido niqueloso
h)
Hidróxido cobáltico
i)
Hidróxido de magnesio
Cuando hablamos de
los óxidos dijimos que había cuatro clases y una de ellas, los óxidos básico u
óxidos metálicos, producía al mezclarse con agua, los hidróxidos.
Esta “mezcla” con
agua es una reacción química y al vamos a estudiar. Tanto la reacción química
como la ecuación química que la representa, se escriben de forma similar a como
lo hicimos con los óxidos. Y por supuesto, también tendremos que balancearlas.
Veamos unos ejemplos:
Na2O (s) + H2O (l) NaOH (ac)
MgO (s) + H2O (l) Mg(OH)2 (ac)
Al2O3 (s) (s) + H2O (l) Al(OH)3 (ac)
Para balancear estas
ecuaciones, esta vez conviene empezar por el metal y luego balancear los
oxígenos e hidrógenos.
Para la primera, hay dos átomos de cada tipo (Na, O,
H) entre los reactivos, y solo uno de cada uno entre los productos, por lo que
solo hará falta multiplicar este por 2.Na2O (s) + H2O (l) 2 NaOH (ac)
En la segunda
ecuación, todos los elementos están equilibrados, por lo que no hace falta
agregar ningún coeficiente. Sin embargo en la tercera, todos los elementos
están en distinto número a cada lado e la flecha. Si comenzamos balanceando el
Al, tendríamos que multiplicar por 2 el hidróxido,
Al2O3 (s) + H2O (l) 2Al(OH)3 (ac)
Ahora, nos quedan 4
oxígenos y 2 hidrógenos como reactivos, y 6 de cada uno como productos. Dado
que el hidrógeno está todo en el mismo compuesto (H2O) será más fácil
seguir el balanceo con este elemento, que con el oxígeno, que está presente en
dos reactivos distintos. De esta forma, si multiplico el H2O por 3, los hidrógenos
quedan equilibrados en 6 átomos a cada lado de la flecha.
Al2O3 (ac) + 3 H2O (l) 2Al(OH)3 (ac)
Si ahora contamos los
átomos de oxígeno, también hay 6 de cada lado y ya están equilibrados. Si no
tenés dudas, nuevamente es tu turno de trabajar.
Ejercicio 8: escribir la reacción de
formación de los hidróxidos de los ejercicios
6 y 7.
Oxoácidos: Son compuestos ternarios, formados por
la combinación de tres elementos distintos, Hidrógeno, Oxígeno y otro elemento,
que por ahora llamaremos E, y que en la mayoría de los casos es no metálico
(más adelante cuando estudiemos los óxidos anfóteros veremos algunos casos en
los que E es un metal). La fórmula general de los oxoácidos es: HaEbOc
Vamos a ver ahora
como formular los oxoácidos. Seguramente en el colegio te habrán enseñado a
obtenerlos por la combinación del agua y el óxido en su valencia adecuada. Esta
forma es correcta, y la usaremos cuando estudiemos las reacciones de obtención.
Sin embargo, no es la única y es muy importante que aprendas a formularlos de
otra forma, pues no siempre cuando estés trabajando vas a poder hacer la
reacción de obtención, más aún, te vas a encontrar con las fórmulas o su nombre,
y no vas a hacer toda la reacción química par saber cuál era su fórmula. Es
mucho más simple saber reconocerlos de esta nueva manera, aunque al principio
te parezca más complicado, con suficiente práctica, vas a poder reconocer
cualquier oxoácido.
Volvamos a la fórmula
general: HaEbOc
Cada subíndice
representa, como siempre, el número de veces que ese elemento está presente en
el compuesto (a= n° H, b= n° E y c= n° O). Para los oxoácidos que se forman por
combinación del óxido con una sola molécula de agua, serán:
a= 1 si el número de oxidación de E es
impar.
a=2 si el número de oxidación de E es
impar.
b=1 siempre, porque se forma partir de una
sola molécula de agua.
c= (n° H + n° de oxidación de E) dividido
2
Expresado en forma
matemática:
c = a + n° oxidación
de E 2
Como ves, es bastante
simple y solo hay que recordar una pequeña cuenta matemática. Veamos unos
ejemplos.
a) Queremos formular
el oxoácido de N(III). Lo primero que hacemos es escribir los elementos
constituyentes del compuesto, respetando siempre el orden de los mismos, sin
colocar ningún subíndice: HNO
Como este es uno de
los oxoácidos que se forman con una molécula de agua, ya sabemos que b=1, por
lo que no ponemos ningún subíndice en el N.
A continuación,
conociendo el n° de oxidación del N, deducimos a y c. Dado que el
N actúa con n° de
oxidación impar, a será igual a 1, y c resulta:
c = 1 + 3 = 2
2 entonces, la fórmula
de nuestro oxoácido será: HNO2
b) Ahora queremos
formular el oxoácido de S(VI). Nuevamente, escribimos el esqueleto de la
fórmula, y como sabemos que se combina con una sola molécula de agua, no pones
ningún subíndice en el S. HSO
Ahora, como el n° de
oxidación del S es +6, a será igual a 2, y c resulta:
c = 2 + 6 = 4
Y la fórmula de
nuestro compuesto es: H2SO4
De la misma forma
podemos formular los oxoácidos si partimos de su nombre.
Pero para eso tenemos
que conocer la nomenclatura de los oxoácidos. La IUPAC admite el uso de la
nomenclatura tradicional, anteponiendo la palabra ácido y agregando la
terminación (y el prefijo si se requiere) correspondiente al índice de
oxidación, al nombre del elemento (se trabaja igual que con los óxidos e hidróxidos).
Así, el oxoácido de N(III) se llama ácido nitroso, porque usa el menor
número de oxidación y el de S será ácido sulfúrico porque usa el mayor.
Tratemos de formular
un oxoácido a partir de su nombre. Por ejemplo el ácido
perbrómico. Si
buscamos el Br en la tabla periódica, vemos que tiene cuatro números de
oxidación con los que puede formar oxoácidos, (+1,+3,+5 y +7), como el nombre
usa el prefijo “per” y la terminación “ico” deducimos que en este caso está
usando el mayor de ellos, +7. Escribimos los elementos en el orden que les corresponde,
y colocamos los subíndices.
HBrO
El compuesto se forma
con una molécula de agua, por lo que b=1, a será igual a 1
porque el Br actúa
con n° de oxidación impar y c resulta:
c = 1 + 7 = 4
2 La fórmula del
ácido perbrómico es: HBrO4
Existe una segunda
forma de nombrar los oxoácidos, que es sencilla y sistemática, recomendada por
la IUPAC. En primer lugar se pone la palabra “oxo”, que indica la
presencia de O en el ácido, con un prefijo, mono, di, tri, tetra, etc., que
indique la cantidad de los mismos (señalada por el subíndice del O). A continuación
se escribe el nombre del elemento central con terminación “ato” seguida de su n° de
oxidación entre paréntesis y en n° romano, finalmente se añade “de Hidrógeno”. Para nuestros
ejemplos anteriores sería:
HNO2 Dioxo nitrato (III)
de hidrógeno , H2SO4 Tetraoxo Sulfato (VI) de hidrógeno
HBrO4 Tetraoxo Bromato
(VII) de hidrógeno
Pero, ¿qué pasa si
nos encontramos con la fórmula y tenemos que nombrarlo?
Necesitamos saber en
qué número de oxidación está actuando el elemento E.
La forma más simple
de determinar el número de oxidación de E es recordando que:
La carga total es cero.
El oxígeno, en este tipo de compuestos,
actúa siempre con número de oxidación –2,
El hidrógeno, en este tipo de compuestos,
con número de oxidación +1,
E actúa con número de oxidación positivo.
Entonces, para saber
en cuál de sus números de oxidación está actuando, debemos sumar los números de
oxidación de todos los elementos que forman el compuesto, multiplicados por su
respectivo subíndice e igualarlos a cero, y de esta ecuación despejar el valor
del número de oxidación. Un ejemplo:
H2SO4
15
Este es uno de los
posibles ácidos del Azufre (S), si planteo la ecuación:
2(+1)+(x)+4(-2)=0
2+x –8=0
x - 6 = 0
⇒ x= +6
El número de
oxidación del S es +6. Ahora ya puedo nombrarlo, es el Acido
Sulfúrico.
Ahora te toca
trabajar a vos. Intentá resolver los siguientes ejercicios.
Ejercicio 9: Escribí
la fórmula de los oxoácidos de los siguientes elementos, con el número de
oxidación indicado:
C (IV) / Cl (I) / Br (III) / I (V) / Br (VII) /
N (III) / S (IV) / N (V)
Ejercicio 10: nombrá
los oxoácidos anteriores.
Vamos a ver ahora,
como se obtienen los oxoácidos. Si repasas lo que estudiamos en óxidos y la
definición de oxoácidos, estás en condiciones de plantear una reacción química
para obtenerlos y de balancearla ¿te sale? Probemos juntos.
Tratemos de obtener
los tres oxoácidos que usamos como ejemplos.
Para el ácido
nitroso, partimos de los reactivos, óxido de N(III) y molécula de agua, para
obtener como producto el oxoácido. La forma más simple es escribir primero el
esqueleto del mismo y a continuación sumar todos los átomos de cada elemento
que están presentes como reactivos, colocando este número como subíndice del elemento
correspondiente en el producto:
N2O3 (g) + H2O (l) HNO (ac)
Tenemos 2 átomos de
N, 2 de H y 4 de O entre los reactivos, o sea que en el producto pondremos:
N2O3 (g) + H2O (l) H2N2O4
Esta, ya sabemos que
no es la fórmula del ácido nitroso ¿qué paso? Nos falta un paso, simplificar.
Acordate que siempre que todos los subíndices de un
compuesto sean múltiplos entre sí o de algún número (generalmente 2) hay que simplificarlos.
En este caso, todos son divisibles por 2, por lo cual, la fórmula quedaría así:
N2O3 (g) + H2O (l) HNO2 (ac)
Ahora sí, tenemos el
ácido nitroso. Pero ¿no te parece que falta algo más?
Estamos trabajando
con una reacción química y dijimos que estas eran representadas por ecuaciones
químicas, que deben estar siempre balanceadas. Si miras bien la ecuación,
tenemos de cada elemento, el doble en los reactivos que en los productos. Como
en este caso solo hay un producto, bastará con multiplicarlo por 2 para
equilibrar la ecuación.
N2O3 (g) + H2O (l) 2 HNO2 (ac)
Ahora sí, la reacción
está completa.
Intentemos hacerlo
con el ácido sulfúrico. Escribimos el óxido y el agua, y del otro lado los
elementos. Podemos saltar el paso de sumar los elementos presentes entre los
reactivos para buscar los subíndices del producto, si ya conocemos cuál es la
fórmula del mismo. Simplemente la escribimos como producto y procedemos a
balancear la reacción.
SO3 (g) + H2O (l) H2SO4 (ac)
Hay dos átomos de H,
uno de S y cuatro de O a cada lado de la reacción, por lo que, en este caso, no
se requiere equilibrar la reacción.
Veamos el último
caso, el ácido perbrómico. Escribimos los elementos de la reacción y la fórmula
del compuesto.
Br2O7 + H2O (l) HBrO4 (ac)
Otra vez tenemos el
doble de cada elemento en los reactivos respecto de los productos, por que será
suficiente con multiplicar este último por 2 para balancear la reacción.
Br2O7 + H2O (l) 2 HBrO4 (ac)
¿Estás listo para
hacerlo solo? Intenta resolver los siguientes ejercicios.
Ejercicio 11: escribí
la reacción de obtención de los oxoácidos que formulaste en el ejercicio
anterior.
Nos queda aprender
algo más sobre los oxoácidos. Te habrás dado cuenta de que hasta ahora solo
trabajamos con aquellos oxoácidos que se forman por combinación con una sola
molécula de agua, esto ya nos dice que debe haber otros que se formen con más
de una molécula de agua. Veamos cuales son.
1) Oxoácidos de Boro:
este elemento forma un solo óxido (B2O3), el cual puede combinarse con una y con
tres moléculas de agua para dar dos oxoácidos distintos.
B2O3 (s) + H2O (l) 2 HBO2 (ac)
B2O3 (s) + 3 H2O (l) H3BO3 (ac)
La pregunta ahora es
¿cómo los nombramos? Porque tenemos dos ácidos con el mismo número de oxidación
y tenemos que usar la misma terminación para indicarlo, pero es indispensable
diferenciarlos, ya que claramente no son el mismo compuesto. ¿qué hacemos?
Simplemente se agrega un prefijo que indica el número de moléculas de agua con
las que se combinó.
Cuando el óxido se combina con
la menor cantidad de moléculas de agua, en este caso una, se
antepone el prefijo “meta”. Cuando el óxido se combina con la mayor
cantidad de moléculas de agua, en este caso tres, se antepone el prefijo “orto”.
Así, nombraríamos los
oxoácidos del B como:
HBO2 Ácido Metabórico
H3BO3 Ácido Ortobórico
2) Oxoácidos de Si:
este elemento también tiene un solo óxido (SiO2) que reacciona con
más de una molécula de agua, para dar oxoácidos. Se puede combinar con una y
con dos moléculas de agua:
SiO2 (s) + H2O (l) H2SiO3 (ac)
SiO2 (s) + 2 H2O (l) H4SiO4 (ac)
¿Cómo los nombramos?
Usamos el mismo mecanismo que para el B.
Cuando el óxido se combina con
la menor cantidad de moléculas de agua, en este caso una, se
antepone el prefijo “meta”. Cuando el óxido se combina con la mayor
cantidad de moléculas de agua, en este caso dos, se antepone el prefijo “orto”.
Los dos oxoácidos de
Si formados se denominan:
H2SiO3 Ácido Metasilícico
H4SiO4 Ácido Ortosilícico
3) Oxoácidos de P, As
y Sb: estos tres elementos, que se ubican en el mismo grupo de la tabla
periódica y tienen el mismo comportamiento. Forman dos óxidos
(con n° de oxidación
+3 y +5) y cada uno de ellos se puede combinar con una, dos y tres moléculas de
agua, para dar tres oxoácidos distintos en cada valencia, lo que suma un total
de seis oxoácidos diferentes para cada elemento. Veamos uno como ejemplo: P(III):
P2O3 (s) + H2O (l) 2 HPO2 (ac)
P2O3 (s) + 2 H2O (l) H4P2O5 (ac)
P2O3 (s) + 3 H2O (l) 2 H3PO3 (ac)
P(V):
P2O5 (s) + H2O (l) 2 HPO3 (ac)
P2O5 (s) + 2 H2O (l) H4P2O7 (ac)
P2O5 (s) + 3 H2O (l) H3PO4 (ac)
Y ahora los
nombramos, siguiendo las reglas anteriores.
Cuando el óxido se combina con
la menor cantidad de moléculas de agua, en este caso una, se
antepone el prefijo “meta”. Cuando el óxido se combina con la mayor
cantidad de moléculas de agua, en este caso tres, se antepone el prefijo “orto”. Y para el caso en que
se combina con dos moléculas de agua, como no es ni la
menor ni la mayor cantidad de moléculas de agua, usamos el prefijo “piro”.
De esta forma nos
quedarían los siguientes nombres:
HPO2 Ácido Metafosforoso
H4P2O5 Ácido Pirofosforoso
H3PO3 Ácido Ortofosforoso
HPO3 Ácido Metafosfórico
H4P2O7 Ácido Pirofosfórico
19
H3PO4 Ácido Ortofosfórico
Es importante que prestes atención a tres
cosas:
La asignación de los prefijos: No usamos “orto” para
tres moléculas de agua, sino para el mayor número de ellas con las que puede
combinarse el óxido, ya que no todos los óxidos que tienen este comportamiento
se combinan con la misma cantidad de moléculas de agua, como pudiste observar
al estudiar cada uno.
El prefijo “orto” es el único que
puede no estar indicado. Por ejemplo, el ácido ortofosfórico,
suele llamarse simplemente ácido fosfórico.
Formulación: No podemos aplicar
las reglas que vimos para los oxoácidos que se forman con una sola molécula de
agua, pues esta solo es válida cuando
b=1, cosa que no
ocurre en estos casos. Hay que aprender sus fórmulas de memoria. Pero no te
asustes, con suficiente práctica y la ayuda de este cuadro podrás hacerlo.
Prefijo B (III) Si
(IV) P, As y Sb
(III)
P, As y Sb
(V)
Meta 112 213 112 113
Piro -- -- 425 427
Orto 313 414 313 314
Moléculas de H2O
1 y 3 1 y 2 1, 2 y 3
1, 2 y 3
Los números en cada
casilla indican los subíndices de cada compuesto según su n° de oxidación y la
cantidad de moléculas de agua con las que se combina el óxido (las
posibilidades se indican en la última fila). Por ejemplo, el ácido metabórico: cruzamos
la primer fila con primera columna y dice 112, esto indica 1H, 1B y 2 O.
Óxidos Anfóteros: Como ya comentamos,
son los óxidos que frente al agua presentan un comportamiento dual, pudiendo
formar hidróxidos u oxoácidos, según la concentración relativa de H+ (protones) y OH- presentes en el medio
en que se produce la reacción. Este comportamiento puede ocurrir para un
elemento con una sola valencia, como Zn y Al; y para elementos con más de una
valencia, en cuyo caso puede ser anfótera una sola de ellas, ejemplo Cr(III), o
las dos, caso de Pb y Sn en sus valencias II y IV.
Además, algunos de
ellos pueden combinarse también con más de una molécula de agua, para formar
oxoácidos. En estos casos, se trabaja igual que antes.
Zn: este elemento forma un solo óxido y se
combina con agua para dar un hidróxido o un oxoácido, como muestran las
siguientes reacciones.
ZnO + H2O Zn(OH)2 (ac)
ZnO + H2O H2ZnO2 (ac) Ácido cínquico
Al: este elemento también forma un solo
óxido, pero puede combinarse con una y tres moléculas de agua para dar
oxoácidos diferentes.
Al2O3 (s) + H2O (l) Al(OH)3 (ac)
Al2O3 (s) + H2O (l) 2 HAlO2 (ac) Ácido Metaalumínico
Al2O3 (s) + 3 H2O(l) 2 H3AlO3 (ac) Ácido Ortoalumínico
Pb y Sn: estos dos elementos presentan comportamientos
similares para sus dos valencias. Ambas pueden combinarse con una y dos
moléculas de agua para formar
oxoácidos.
PbO (s) + H2O (l) Pb(OH)2 (ac) Hidróxido Plumboso
PbO (s) + H2O (l) H2PbO2 (ac) Ácido Metaplumboso
PbO (s) + 2 H2O (l) H4PbO3 (ac) Ácido Ortoplumboso
PbO2 (s) + H2O (l) Pb(OH)4 (ac) Hidróxido Plúmbico
PbO2 (s) + H2O (l) H2PbO3 (ac) Ácido Metaplúmbico
PbO2 (s) + 2 H2O (l) H4PbO4 (ac) Ácido Ortoplúmbico
Cr: este elemento presenta anfoterismo solo
para una de sus valencias (III), y solo se combina con una molécula de agua
para dar oxoácidos.
Cr2O3 (s) + H2O (l) Cr(OH)3 (ac) Hidróxido Cromoso o
de cromo (III)
Cr2O3 (s) + H2O (l) HCrO2 (ac) Hidróxido Ácido
Cromoso
Hidruros: son compuestos binarios de H, actuando
con número de oxidación +1 (forma un catión) o –1 (forma un anión). En el
primer caso, forma los hidrácidos; mientras que en el segundo, forma parte de
los compuestos llamados “hidruros”, que son los que
veremos a continuación.
Para formar un
hidruro, el H- se puede combinar con cualquier elemento
que posee una carga positiva, sea metal o no metal.
Su fórmula general,
para hidruros metálicos, es: MeHn
Como siempre, al ser
un compuesto binario, los elementos que lo componen intercambian sus números de
oxidación, que se colocan como subíndices. Es importante que prestes atención a
como está escrita la fórmula, con el H en segundo lugar, al revés que los
hidrácidos.
Para nombrarlos, se
indica “hidruro de” seguida del nombre
del metal.
Ejemplo:
NaH Hidruro de sodio
MgH2 Hidruro de Magnesio
Para los hidruros de
elementos no metálicos, F, Cl, Br, I, S, Se, Te, etc., se escribe igual que los
hidrácidos, pero siempre indicando su estado de agregación, que es gaseoso.
HnE(g)
Para nombrarlos se
indica primero, el nombre del elemento con terminación “uro” seguido por “de hidrógeno”. Por ejemplo:
HCl Cloruro de hidrógeno
H2Se Selenuro de
hidrógeno
Ejercicio 12: escribí
la formula de los siguientes compuestos.
Hidruro de calcio
Hidruro de magnesio
Hidruro de hierro(II)
Hidruro de niquel
(III)
Sulfuro de hidrógeno
Yoduro de hidrógeno
Ejercicio 13: nombrá
los siguientes compuestos.
LiH
CoH3
22
AlH3
HI
TeH2
Hidrácidos: este segundo tipo de ácidos, se forma por
combinación de H con un elemento no metálico, F, Cl, Br o I actuando con número
de oxidación -1, o S, Se y
Te actuando con
número de oxidación -2. Son compuestos binarios del H, en los que este elemento
actúa con número de oxidación +1, y existen como tales disueltos en agua. La
fórmula de los hidrácidos es:
HEn
Siendo E el elemento
no metálico y n su valencia.
Para formular estos
compuestos, partamos otra vez de sus elementos y sus números de oxidación. Por
ejemplo:
H+ (ac) + Cl- (ac) HCl (ac)
H+ (ac) + Se2- (ac) H2Se (ac)
Para nombrarlos, se
indica el tipo de compuesto, ácido seguido del nombre
del elemento terminado en “hídrico”. Para los ejemplos:
HCl Ácido Clorhídrico
H2Se Ácido Selenhídrico
Para obtenerlos, se
burbujea el hidruro gaseoso en agua, formándose el correspondiente hidrácido.
HCl (g) HCl (ac)
H2S (s) H2S (ac)
¿Te animas a hacerlo
solo? Entonces resolvé los siguientes ejercicios.
Ejercicio 14: Escribí
la fórmula de:
Acido fluorhídrico
Acido telurhídrico
Acido bromhídrico
Ejercicio 15: Nombrá
los siguientes hidrácidos:
23
HI / H2S
Ejercicio 16: escribí
la reacción de formación de los hidrácidos anteriores.
Sales: estos compuestos químicos se forman por combinación
de un hidróxido con un ácido, ya sea un oxoácido o un hidrácido. Las sales
provenientes de oxoácidos se denominan oxosales y aquellas que provienen
de hidrácidos se denominan genéricamente sales de uro, por ser esta la
terminación de su nombre.
Para obtener su
fórmula, se hace perder al ácido sus H dejando los elementos restantes con una
carga negativa “igual al número de H perdidos”; por otro lado, el hidróxido
pierde sus oxidrilos dejando al metal como ión con carga positiva.
Estos dos iones
interaccionan entre sí para formar la sal. La carga del catión se coloca sin
signo, como subíndice del anión y la carga del anión, sin signo, como subíndice
del catión.
Veamos un ejemplo
simple, con una sal de uro:
NaOH (ac) + HCl (ac) Na+ + OH- + H+ + Cl- NaCl (ac) + H2O (l)
La reacción total se
escribe:
NaOH (ac) + HCl (ac) NaCl (ac) + H2O (l)
Por supuesto, como
toda reacción química, se debe balancear. En este caso, la reacción ya está
balanceada, pero veamos uno en que esto no ocurre: Ca(OH)2 (ac) + HCl (ac) Ca2+ + 2 OH- + H+ + Cl- CaCl2 (ac) + H2O (l) Ca(OH)2 (ac) + 2 HCl (ac) CaCl2 (ac) + 2 H2O (l)
Probemos ahora con
una oxosal:
NaOH (ac) + HClO (ac) Na+ + OH- + H+ + ClO- NaClO (ac) + H2O (l)
La reacción total
también está balanceada y es:
NaOH (ac) + HClO (ac) NaClO (ac) + H2O (l)
Otro caso:
NaOH (ac) + H2SO4 (ac) Na+ + OH- + 2 H+ + SO4
2- Na2SO4 (ac) + H2O (l)
La reacción total
ahora es:
24
2 NaOH (ac) H2SO4 (ac) Na2SO4 (ac) + 2 H2O (l)
Un ejemplo más: Ca(OH)2 (ac) + H2SO4 (ac) Ca2+ + 2OH- + 2H+ + SO4
2- Ca2(SO4)2 (ac) + H2O(l)
En este caso, los
subíndices del catión y del anión, son múltiplos entre sí, por lo cual, se
simplifican, y la reacción total resulta:
Ca(OH)2 (ac) + H2SO4 (ac) CaSO4 (ac) + H2O (l)
Una ayudita para
aprender a balancear estas reacciones: empezá por el elemento metálico, después
equilibrá el elemento principal del oxoácido, y por último, los H y O, en
cualquier orden. Vas a ver que si todos tus compuestos están bien escritos y la
reacción está bien planteada, después de balancear el metal, el elemento
principal del oxoácido y el H (o el O) el elemento restante debería estar
balanceado.
La reacción entre un
hidróxido y un ácido se llama reacción de neutralización, y en ella también
se produce agua, por combinación de los H+ y OH- que perdieran ambos compuestos iniciales.
¿Cómo las nombramos?
Se indica primero el nombre del anión, proveniente del ácido con una
terminación particular, seguido del nombre del catión seguido de su número de
valencia, en romanos y entre paréntesis, si puede actuar con más de uno.
También podes usar la nomenclatura tradicional para indicar la valencia del metal,
es bastante común cuando este posee más de una.
Para nombrar las
oxosales:
Si el oxoácido termina en “oso” se reemplaza por “ito”.
Si el oxoácido termina en “ico” se reemplaza por “ato”.
Si el nombre del oxoácido incluía un
prefijo, este no cambia.
También se puede usar
la nomenclatura sistemática, en la que solo se debe omitir la palabra ácido y
reemplazar “hidrógeno” por el nombre del catión, indicando si es preciso, su
valencia.
Para las sales de
uro:
La terminación “hídrico” se reemplaza por “uro” (de allí su nombre).
Veamos como ejemplo
las sales que formamos:
La sal NaClO, proviene de la
combinación del ácido hipocloroso con hidróxido de sodio, reemplazando oso por
ito, la llamamos “hipoclorito de sodio”, o por la nomenclatura
sistemática, “oxoclorato (I) de sodio”.
La sal Na2SO4 se forma por
combinación de ácido sulfúrico con hidróxido de sodio, reemplazando ico por
ato, se llama “sulfato de sodio” o por la nomenclatura
sistemática, “oxosulfato (VI) de sodio”.
Para la sal NaCl debemos cambiar
“hídrico” por “uro”, entonces se la llama
“cloruro de
sodio”.
Por lo mismo, la sal CaCl2 se denomina “cloruro de
calcio”.
La última sal que nos
resta nombrar es CaSO4 y la llamamos “sulfato de
calcio” o por la nomenclatura sistemática, “oxosulfato (VI)
de sodio”.
Tratemos de nombrar
algunas sales partiendo de su fórmula:
1) Fe(NO3)3
Para nombrarla,
debemos reconocer el catión y el anión que la forman, así como los subíndices
de cada uno. No te olvides, que estos indican la carga del anión y del catión.
En este caso, el catión es el metal hierro (Fe) y no tiene subíndice
El anión, por otro lado tiene un subíndice 3, nos está indicando
que esta es una sal de hierro (III) o férrica. Si todavía no recordás
el nombre del anión o te resulta difícil reconocerlo, tenés que pensar de qué
ácido se partió. Es claro, por la presencia del O, que hay que pensar en un
oxoácido. ¿Cuál? Mirando el elemento central reconocemos al N. Este forma dos
oxoácidos, con valencias
(III) y (V), si
repasas los mismos, vas a ver que nuestro ejemplo corresponde al ácido nítrico,
formada con la valencia (V). Entonces, usando las reglas de nomenclatura, la
sal se llama nitrato de hierro (III), nitrato férrico o usando la nomenclatura
sistemática, trioxonitrato (V) de hierro (III).
2) ZnSO3
En este caso,
reconocemos el catión como zinc y el anión como sulfito. Ninguno presenta
subíndice, pero esto no implica que sean 1. Sabemos que el carbonato tiene una
carga total de 2-, y si buscamos en la tabla periódica, vemos que el Zn posee
un número de oxidación igual a 2+. En este caso, ambos se simplificaron. Es muy
importante prestar atención a este punto porque podes confundirte y nombrar mal
la sal. El nombre de este compuesto es “sulfito de
zinc” o “sulfito
cínquico” o “trioxosulfato
(IV) de zinc”.
3) PbBr2
Esta es una sal
binaria, formada por Pb (II) como catión, Br- como anión. Se llama
“bromuro de plomo (II)” o “bromuro
plumboso”.
Intentemos ahora en
sentido inverso, escribir la fórmula partiendo del nombre del compuesto.
1) Tetraoxoclorato
(VII) de Al(III): el metal es, obviamente, Al(III). El anión tiene 4
átomos de O (tetraoxo) y como elemento central Cl con número de valencia (VII),
por lo que corresponde al anión ClO4
- . La fórmula de la
sal es: Al(ClO4)3
¿Cómo se llamaría
esta sal por la nomenclatura tradicional?
2) Iodito cuproso: el catión es Cu(I) y
el anión está formado por I (II). Su fórmula será:
CuIO2
Ahora es tu turno.
Resolvé los siguientes ejercicios.
Ejercicio 17: Nombrá
las siguientes sales:
a) KNO2
b) BaCO3
c) Na4PbO4
d) Cu3(PO3)2
e) AgCl
f) CaCO3
g) Sr(BO2)2
h) Li2SO4
i) CdSnO3
j) NiBr2
k) FeSO3
l) Cr(ClO)3
m) Au(ClO4)3
n) Al2(IO2)3
o) Cu4Sb2O5
Ejercicio 18: escribí
la fórmula de las siguientes sales
a) Sulfato de
estroncio
b) Bromuro férrico
c) Metaantimonito de
cinc
d) Pirofosfato de
plumboso
e) Piroantimonito de
plúmbico
f) Telurito estañoso
g) Carbonato de
calcio
h) Ortofosfito
cúprico
i) Permanganato de
potasio
j) Floururo argéntico
k) Carbonato de bario
l) Sulfato de litio
m) Plumbito de sodio
n) Metaborato de
estroncio
o) Carbonato férrico
p) Estañito cobáltico
q) Nitrato cobaltoso
r) Perclorato
magnésico
s) Bromito estágnico
t) Iodato plumboso
u) Hipoclorito
alumínico
Ejercicio 19: Escribí
las reacciones de obtención de los compuestos de los ejercicios anteriores.
Sales ácidas y básicas: algunas sales se
forman por neutralización incompleta de los ácidos o las bases que las
originan, cuando estos poseen más de un H u oxidrilo, respectivamente. En estos
casos, la fórmula de la misma incluye uno o más H si es una sal ácida, y uno o
más oxidrilos si la sal es básica. Solo hay que prestar atención, porque al no
perder todos los H u OH- , la carga total de los iones formados no es la misma.
Para nombrarlas, solo
debe indicarse, luego del anión, la presencia de H u oxidrilos con la palabra
ácida o básica, respectivamente, e indicando su número usando los prefijos di,
tri, etc.
Sulfato ácido de calcio: Ca(HSO4)2
Sulfato básico de calcio [Ca(OH)]2SO4
Nota: este tema será
practicado en las clases presenciales.
Peróxidos y superóxidos: son compuestos formados
por un metal y O, actuando este último con número de oxidación mayor a -2, pero
también negativos. Una característica particular de estos compuesto, es que el
O nunca se halla en forma monoatómica, sino
diatómica. Para nombrarlos simplemente se indica el tipo de compuesto, peróxido
o superóxido, según corresponda, seguido del nombre del metal.
Peróxidos: en ellos el O actúa con número de
oxidación -1 y al ser diatómico la
fórmula de su anión
es O2
2-(anión peróxido).
Ejemplos:
Peróxido de sodio: Na2O2
El subíndice del
sodio no es otra cosa que la carga del anión peróxido. Este, por su parte,
tiene su propio subíndice y como el sodio posee valencia +1 no se agrega nada.
Peróxido de Magnesio: MgO2
En este caso, ambos
iones, poseen una carga igual a 2, Mg2+ y O2
2-, por lo que al colocar
los respectivos subíndices, estos se cancelan y solo permanece el que indica el
tipo de anión.
Peróxido férrico: Fe2 (O2)3
Para este caso, los
iones poseen diferente carga, por lo que no se cancelan los subíndices, y es
necesario colocar el anión peróxido entre paréntesis.
Superóxidos: el oxígeno actúa con
número de oxidación -0,5 y al ser diatómico la fórmula de su anión es O2
- (anión superóxido).
Ejemplos:
Superóxido de litio: LiO2
Como ambos iones
tienen una carga igual a 1, ninguno lleva subíndice.
Superóxido de estaño: Sn(O2)2
En este caso, se
indica como subíndice la valencia del Sn (II), poniendo entre paréntesis el
anión superóxido.
Importante: El subíndice 2 del
oxígeno que indica el tipo particular de enlace
diatómico nunca se simplifica, por lo
que debes aprender bien los tres tipos de compuestos binarios que forma el
oxígeno y no confundirlos. A modo de ejemplo, para que veas la diferencia entre
ellos:
Oxido de estaño: SnO
Peróxido de estaño: SnO2
Superóxido de estaño: Sn(O2)2
Sustancias puras y mezclas.
La materia se presenta ante nuestros ojos en «porciones».
Llamamos sistemas materiales a todas estas porciones que podemos aislar para el estudio de sus propiedades
“Definición: Cuerpo material es toda forma de materia que tiene límites propios bien definidos. Definición: Sistema material Es toda forma de materia que carece de morfología (forma) propia o cuyos límites son imprecisos, ya sea por su naturaleza o por su extensión”.

Cuerpo material

Sistema material
Los sistemas materiales se encuentran formando mezclas, como el aire, o sustancias puras, como el azúcar o el oro.
Las mezclas están formadas por dos o más sustancias puras que pueden separarse por procesos físicos (son cambios que no alteran la naturaleza de la materia). Las sustancias puras están formadas por un solo componente, no pudiendo separarse en otros por procesos físicos.

Mezclas de rocas

Oro puro
Es difícil saber si una sustancia es pura o no a simple vista. Para comprobarlo tenemos que fijarnos en sus propiedades físicas (densidad, punto de fusión o ebullición, etc.).
Definición: Una sustancia pura tiene sus propiedades características bien definidas y constantes. Una mezcla no tiene propiedades definidas.

Cuerpo material

Sistema material

Mezclas de rocas

Oro puro
3.- Sustancias simples y compuestos
Definición: Una sustancia simple es una sustancia pura que está formada por una sola clase de átomos. Definición: Un compuesto es una sustancia pura formada por átomos diferentes.

Elemento. Sodio metálico

Estructura de átomos de sodio

Compuesto. Halita. ClNa. Sal común

Estructura del ClNa
Para saber si una sustancia pura es un elemento o un compuesto, basta con saber si puede descomponerse en otras sustancias más sencillas o no. Si puede descomponerse, es un compuesto ; en caso contrario, es un elemento .
Definición: Una reacción química es un proceso mediante el cual una o varias sustancias con unas propiedades definidas, denominadas reactivos , se transforman en otras sustancias con propiedades diferentes a las iniciales, denominadas productos .
2H 2O  2H2 + O2
Hay infinidad de sustancias puras. Cada sustancia se representa de manera simplificada mediante una fórmula química . Esta consta de los símbolos químicos (que representan deforma abreviada los elementos de la sustancia) y de unos subíndices que nos indican el número de átomos que existen en la molécula. La fórmula del agua es H2O, y quiere decir que en cada molécula de este compuesto hay dos átomos de hidrógeno (H) y un átomo de oxígeno (O).
2H2 + O2
Hay infinidad de sustancias puras. Cada sustancia se representa de manera simplificada mediante una fórmula química . Esta consta de los símbolos químicos (que representan deforma abreviada los elementos de la sustancia) y de unos subíndices que nos indican el número de átomos que existen en la molécula. La fórmula del agua es H2O, y quiere decir que en cada molécula de este compuesto hay dos átomos de hidrógeno (H) y un átomo de oxígeno (O).

Elemento. Sodio metálico

Estructura de átomos de sodio

Compuesto. Halita. ClNa. Sal común

Estructura del ClNa
4.- Elementos químicos en el universo
Todos los elementos que actualmente conocemos y que forman parte del universo están representados en el sistema periódico . Están colocados siguiendo un orden creciente al número de protones y electrones que tienen sus átomos.
Para ver el Sistema periódico pincha aquí
Cada elemento viene representado por su símbolo , que consta de una o dos letras. A veces el símbolo es la parte de su nombre en castellano, (Oxígeno, O; Magnesio, Mg) pero en otros es parte de nombre en latín o griego, (Sodio, Na de Natrum, Azufre, S de sulphur).
Estudiando las propiedades de los elementos del sistema periódico se puede hacer una clasificación muy general en:
• Metales . Son buenos conductores del calor y de la electricidad, en general, tienen puntos de fusión y ebullición altos y densidades altas.
• No metales : Son malos conductores, tienen puntos de fusión y ebullición bajos y poseen densidades bajas.
Es mejor es clasificar los elementos en grupos o familias , que se corresponden con cada una de las columnas del sistema periódico. Todos los elementos que forman una columna tienen propiedades muy parecidas.
Alcalinos, alcalinotérreos, térreos, carbonoideos, nitrogenoideos, calcógenos o anfígenos, halógenos y gases nobles. Metales pesados (transición), lantánidos y actínidos.
5. Tipos de mezclas
5.1. Mezclas heterogéneas
Definición: Una mezcla es heterogénea cuando sus componentes pueden ser distinguidos a simple vista. Definición: Una mezcla es homogénea cuando sus componentes no se pueden distinguir a simple vista.


Mezclas homogéneas.


Mezclas homogéneas.
5.2.- Mezclas homogéneas. Disoluciones
Las mezclas homogéneas también se llaman disoluciones y están formadas por dos o más componentes. Pueden ser disoluciones de sólidos, líquidos y gases.
Definición: Soluto es el componente que se en cuentra en menor proporción en una disolución.
Definición: Disolvente es el componente que está mayor proporción en una disolución.
Tipos de disoluciones.
Las disoluciones pueden ser:
• Diluidas si la cantidad de soluto es muy pequeña con relación a la cantidad de disolvente. • Concentradas si la cantidad de soluto es muy alta en relación a la cantidad de disolvente. • Saturada: Si no admite más soluto y si añadimos más este se queda en el fondo.



Definición: La concentración de una disolución es la cantidad de soluto que hay en una determinada cantidad de disolvente.
Se puede expresar en forma de porcentaje de masa : 20 % de masa sal en agua indica que hay 20 g de sal por cada 100g de disolución ( 80 g de agua). También se puede expresar en volumen : en g de soluto por litro de disolución (g/L).



6.- Separación de mezclas
Las técnicas de separación de una mezcla se basan en las diferentes propiedades físicas de sus componentes (densidad, punto de ebullición, etc.). Independientemente del tipo de mezcla, sus componentes se pueden separar a través de diversos métodos físicos .
6.1.- Técnicas de separación de mezclas homogéneas.
Los métodos más usados son: cristalización, destilación y la extracción para mezclas homogéneas , y Filtración, decantación y separación magnética para mezclas heterogéneas.
Cristalización
Se utiliza para separar un sólido disuelto en un líquido. Por ejemplo, si se tiene una disolución de agua y sal, y se deja evaporar el agua, aparecerán cristales de sal en el fondo. Si la evaporación es muy lenta, es posible que se formen unos bonitos cristales cúbicos de cloruro de sodio (sal común). Destilación
Esta técnica se emplea para separar líquidos que tienen puntos de ebullición muy diferentes o para separar los líquidos de impurezas sólidas que no se vaporizan.
Por ejemplo, si se destila agua teñida con algún colorante, se obtiene en el destilado agua pura limpia (sin colorear) y en el matraz de destilación se queda el colorante. Extracción
Es una técnica basada en la diferente solubilidad que una sustancia tiene en dos líquidos inmiscibles, es decir, que no se pueden mezclar entre ellos.
Por ejemplo, el yodo es muy poco soluble en agua, pero se disuelve muy bien en cloroformo. Si se tiene una disolución de yodo en agua, que es de color parda, y se quiere «extraer» el yodo de ella, basta con agitar la disolución con un poco de cloroformo. Así, la solución acuosa que era de color pardo queda incolora al pasar el yodo a teñir de rosa la disolución de cloroformo. 
Cristalizaciones de disoluciones de agua con diferentes sales
Destilación
Extracción de Yodo disuelto en agua.
Se utiliza para separar un sólido disuelto en un líquido. Por ejemplo, si se tiene una disolución de agua y sal, y se deja evaporar el agua, aparecerán cristales de sal en el fondo. Si la evaporación es muy lenta, es posible que se formen unos bonitos cristales cúbicos de cloruro de sodio (sal común).
Esta técnica se emplea para separar líquidos que tienen puntos de ebullición muy diferentes o para separar los líquidos de impurezas sólidas que no se vaporizan.
Por ejemplo, si se destila agua teñida con algún colorante, se obtiene en el destilado agua pura limpia (sin colorear) y en el matraz de destilación se queda el colorante.
Es una técnica basada en la diferente solubilidad que una sustancia tiene en dos líquidos inmiscibles, es decir, que no se pueden mezclar entre ellos.
Por ejemplo, el yodo es muy poco soluble en agua, pero se disuelve muy bien en cloroformo. Si se tiene una disolución de yodo en agua, que es de color parda, y se quiere «extraer» el yodo de ella, basta con agitar la disolución con un poco de cloroformo. Así, la solución acuosa que era de color pardo queda incolora al pasar el yodo a teñir de rosa la disolución de cloroformo.

Cristalizaciones de disoluciones de agua con diferentes sales

Destilación

Extracción de Yodo disuelto en agua.
6.2.- Técnicas de separación de mezclas heterogéneas.
Criba o tamizado
Si se quiere separar sólidos de diferentes tamaños, se puede pasar la mezcla a través de un tamiz.
El sólido de mayor tamaño quedará retenido, mientras que el que tiene el grano más fino, pasará a través del tamiz.
Filtración
Se utiliza para separar la mezcla de un líquido con un sólido que no se disuelve en ese líquido. Por ejemplo, si se pasa una mezcla de arena y agua a través de un filtro, la arena queda en el papel de filtro y en el líquido filtrado solo pasa el agua limpia.
Sedimentación
Cuando hay un sólido en suspensión en el seno de un líquido, al dejarlo en reposo, por la acción de la gravedad, el sólido se deposita en el fondo. Por ejemplo, se puede emplear para separar la arcilla del agua. Se puede acelerar el proceso mediante una centrifugadora; la técnica, en este caso, se denomina centrifugación. 
Tamizado.
Filtros realizados con "papel de filtro" en laboretorio escolar.
Sedimentación de diferentes solidos inmiscibles en agua.
Decantación
Se emplea para separar líquidos inmiscibles, como por ejemplo el aceite y el agua. Para ello se utiliza el embudo de decantación. Accionando la llave del embudo se deja pasar el líquido más denso y en el interior del embudo queda el líquido menos denso. Separación magnética
Se usa cuando en una mezcla existen sustancias con propiedades magnéticas.
Basta con pasar un imán para que las sustancias con propiedades magnéticas se separen de las que no las tienen. Este proceso se utiliza, por ejemplo, en las plantas de reciclaje. 
Decantación.
Separación magnética.
La tensión superficial:
En un fluido cada molécula interacciona con las que le rodean. El radio de acción de las fuerzas moleculares es relativamente pequeño, abarca a las moléculas vecinas más cercanas. Vamos a determinar de forma cualitativa, la resultante de las fuerzas de interacción sobre una molécula que se encuentra en
- A, el interior del líquido
- B, en las proximidades de la superficie
- C, en la superficie
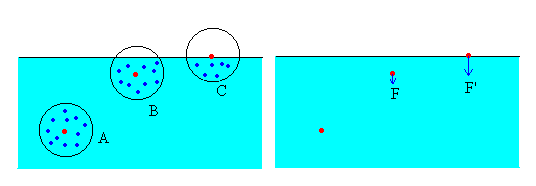
Consideremos una molécula (en color rojo) en el seno de un líquido en equilibrio, alejada de la superficie libre tal como la A. Por simetría, la resultante de todas las fuerzas atractivas procedentes de las moléculas (en color azul) que la rodean, será nula.
En cambio, si la molécula se encuentra en B, por existir en valor medio menos moléculas arriba que abajo, la molécula en cuestión estará sometida a una fuerza resultante dirigida hacia el interior del líquido.
Si la molécula se encuentra en C, la resultante de las fuerzas de interacción es mayor que en el caso B.
La fuerzas de interacción, hacen que las moléculas situadas en las proximidades de la superficie libre de un fluido experimenten una fuerza dirigida hacia el interior del líquido.
Como todo sistema mecánico tiende a adoptar espontáneamente el estado de más baja energía potencial, se comprende que los líquidos tengan tendencia a presentar al exterior la superficie más pequeña posible.
Criba o tamizado
Si se quiere separar sólidos de diferentes tamaños, se puede pasar la mezcla a través de un tamiz.El sólido de mayor tamaño quedará retenido, mientras que el que tiene el grano más fino, pasará a través del tamiz.
Filtración
Se utiliza para separar la mezcla de un líquido con un sólido que no se disuelve en ese líquido. Por ejemplo, si se pasa una mezcla de arena y agua a través de un filtro, la arena queda en el papel de filtro y en el líquido filtrado solo pasa el agua limpia.
Sedimentación
Cuando hay un sólido en suspensión en el seno de un líquido, al dejarlo en reposo, por la acción de la gravedad, el sólido se deposita en el fondo. Por ejemplo, se puede emplear para separar la arcilla del agua. Se puede acelerar el proceso mediante una centrifugadora; la técnica, en este caso, se denomina centrifugación.
Tamizado.

Filtros realizados con "papel de filtro" en laboretorio escolar.

Sedimentación de diferentes solidos inmiscibles en agua.
Se emplea para separar líquidos inmiscibles, como por ejemplo el aceite y el agua. Para ello se utiliza el embudo de decantación. Accionando la llave del embudo se deja pasar el líquido más denso y en el interior del embudo queda el líquido menos denso.
Se usa cuando en una mezcla existen sustancias con propiedades magnéticas.
Basta con pasar un imán para que las sustancias con propiedades magnéticas se separen de las que no las tienen. Este proceso se utiliza, por ejemplo, en las plantas de reciclaje.

Decantación.

Separación magnética.
En un fluido cada molécula interacciona con las que le rodean. El radio de acción de las fuerzas moleculares es relativamente pequeño, abarca a las moléculas vecinas más cercanas. Vamos a determinar de forma cualitativa, la resultante de las fuerzas de interacción sobre una molécula que se encuentra en
- A, el interior del líquido
- B, en las proximidades de la superficie
- C, en la superficie

Consideremos una molécula (en color rojo) en el seno de un líquido en equilibrio, alejada de la superficie libre tal como la A. Por simetría, la resultante de todas las fuerzas atractivas procedentes de las moléculas (en color azul) que la rodean, será nula.
En cambio, si la molécula se encuentra en B, por existir en valor medio menos moléculas arriba que abajo, la molécula en cuestión estará sometida a una fuerza resultante dirigida hacia el interior del líquido.
Si la molécula se encuentra en C, la resultante de las fuerzas de interacción es mayor que en el caso B.
La fuerzas de interacción, hacen que las moléculas situadas en las proximidades de la superficie libre de un fluido experimenten una fuerza dirigida hacia el interior del líquido.
Como todo sistema mecánico tiende a adoptar espontáneamente el estado de más baja energía potencial, se comprende que los líquidos tengan tendencia a presentar al exterior la superficie más pequeña posible.
Coeficiente de tensión superficial
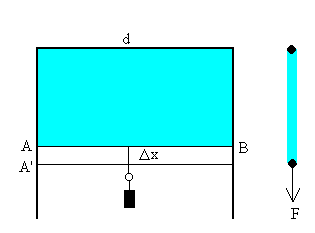
Se puede determinar la energía superficial debida a la cohesión mediante el dispositivo de la figura.Una lámina de jabón queda adherida a un alambre doblada en doble ángulo recto y a un alambre deslizante AB. Para evitar que la lámina se contraiga por efecto de las fuerzas de cohesión, es necesario aplicar una fuerza F al alambre deslizante.
La fuerza F es independiente de la longitud x de la lámina. Si desplazamos el alambre deslizante una longitud Dx, las fuerzas exteriores han realizado un trabajo FDx, que se habrá invertido en incrementar la energía interna del sistema. Como la superficie de la lámina cambia en DS=2dDx (el factor 2 se debe a que la lámina tiene dos caras), lo que supone que parte de las moléculas que se encontraban en el interior del líquido se han trasladado a la superficie recién creada, con el consiguiente aumento de energía.
Si llamamos a g la energía por unidad de área, se verificará que

la energía superficial por unidad de área o tensión superficial se mide en J/m2 o en N/m.
La tensión superficial depende de la naturaleza del líquido, del medio que le rodea y de la temperatura. En general, la tensión superficial disminuye con la temperatura, ya que las fuerzas de cohesión disminuyen al aumentar la agitación térmica. La influencia del medio exterior se comprende ya que las moléculas del medio ejercen acciones atractivas sobre las moléculas situadas en la superficie del líquido, contrarrestando las acciones de las moléculas del líquido.
Tensión superficial de los líquidos a 20ºC
Líquido g (10-3 N/m) Aceite de oliva 33.06 Agua 72.8 Alcohol etílico 22.8 Benceno 29.0 Glicerina 59.4 Petróleo 26.0
Fuente: Manual de Física, Koshkin N. I. , Shirkévich M. G.. Editorial Mir (1975)
 | Se puede determinar la energía superficial debida a la cohesión mediante el dispositivo de la figura.Una lámina de jabón queda adherida a un alambre doblada en doble ángulo recto y a un alambre deslizante AB. Para evitar que la lámina se contraiga por efecto de las fuerzas de cohesión, es necesario aplicar una fuerza F al alambre deslizante. |
Si llamamos a g la energía por unidad de área, se verificará que
la energía superficial por unidad de área o tensión superficial se mide en J/m2 o en N/m.
La tensión superficial depende de la naturaleza del líquido, del medio que le rodea y de la temperatura. En general, la tensión superficial disminuye con la temperatura, ya que las fuerzas de cohesión disminuyen al aumentar la agitación térmica. La influencia del medio exterior se comprende ya que las moléculas del medio ejercen acciones atractivas sobre las moléculas situadas en la superficie del líquido, contrarrestando las acciones de las moléculas del líquido.
Tensión superficial de los líquidos a 20ºC
| Líquido | g (10-3 N/m) |
| Aceite de oliva | 33.06 |
| Agua | 72.8 |
| Alcohol etílico | 22.8 |
| Benceno | 29.0 |
| Glicerina | 59.4 |
| Petróleo | 26.0 |
Medida de la tensión superficial de un líquido
El método de Du Nouy es uno de los más conocidos. Se mide la fuerza adicional ΔF que hay que ejercer sobre un anillo de aluminio justo en el momento en el que la lámina de líquido se va a romper.
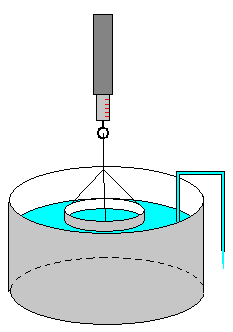
La tensión superficial del líquido se calcula a partir del diámetro 2R del anillo y del valor de la fuerza ΔF que mide el dinamómetro.
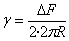 El líquido se coloca en un recipiente, con el anillo inicialmente sumergido. Mediante un tubo que hace de sifón se extrae poco a poco el líquido del recipiente.
El líquido se coloca en un recipiente, con el anillo inicialmente sumergido. Mediante un tubo que hace de sifón se extrae poco a poco el líquido del recipiente.
En la figura se representa:
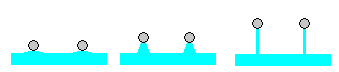
-
El comienzo del experimento
-
Cuando se va formando una lámina de líquido.
-
La situación final, cuando la lámina comprende únicamente dos superficies (en esta situación la medida de la fuerza es la correcta) justo antes de romperse.
Si el anillo tiene el borde puntiagudo, el peso del líquido que se ha elevado por encima de la superficie del líquido sin perturbar, es despreciable.
No todos los laboratorios escolares disponen de un anillo para realizar la medida de la tensión superficial de un líquido, pero si disponen de portaobjetos para microscopio. Se trata de una pequeño pieza rectangular de vidrio cuyas dimensiones son a=75 mm de largo, b=25 mm de ancho y aproximadamente c=1 mm de espesor, su peso es aproximadamente 4.37 g.
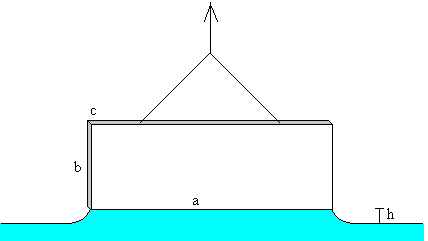 Se pesa primero el portaobjetos en el aire y a continuación, cuando su borde inferior toca la superficie del líquido. La diferencia de peso ΔF está relacionada con la tensión superficial
ΔF=2·γ(a+c)
Se empuja el portaobjetos hacia arriba cuasiestáticamente. Justamente, cuando va a dejar de tener contacto con la superficie del líquido, la fuerza F que hemos de ejercer hacia arriba es igual a la suma de:
Se pesa primero el portaobjetos en el aire y a continuación, cuando su borde inferior toca la superficie del líquido. La diferencia de peso ΔF está relacionada con la tensión superficial
ΔF=2·γ(a+c)
Se empuja el portaobjetos hacia arriba cuasiestáticamente. Justamente, cuando va a dejar de tener contacto con la superficie del líquido, la fuerza F que hemos de ejercer hacia arriba es igual a la suma de:
-
El peso del portaobjetos mg
-
La fuerza debida a la tensión superficial de la lámina de líquido que se ha formado 2·γ(a+c)
-
El peso del líquido ρgach que se ha elevado una altura h, sobre la superficie libre de líquido. Siendo ρ es la densidad del líquido.
Para un portaobjetos de la dimensiones señaladas, que toca la superficie del agua, h es del orden de 2.3 mm (véase el artículo citado en las referencias)
-
La fuerza debida a la tensión superficial es 2·γ(a+c)=2·72.8·10-3·(0.075+0.001)=11.07·10-3 N
-
El peso de la lámina de agua es del orden de ρgach=1000·9.8·0.075·0.001·0.0023=1.70·10-3 N
Para que la simulación sea lo más simple posible, no se ha tenido en cuenta el peso de la lámina de líquido que se eleva por encima de la superficie libre.
El método de Du Nouy es uno de los más conocidos. Se mide la fuerza adicional ΔF que hay que ejercer sobre un anillo de aluminio justo en el momento en el que la lámina de líquido se va a romper.
 |
La tensión superficial del líquido se calcula a partir del diámetro 2R del anillo y del valor de la fuerza ΔF que mide el dinamómetro.
El líquido se coloca en un recipiente, con el anillo inicialmente sumergido. Mediante un tubo que hace de sifón se extrae poco a poco el líquido del recipiente.
|
En la figura se representa:

- El comienzo del experimento
- Cuando se va formando una lámina de líquido.
- La situación final, cuando la lámina comprende únicamente dos superficies (en esta situación la medida de la fuerza es la correcta) justo antes de romperse.
Si el anillo tiene el borde puntiagudo, el peso del líquido que se ha elevado por encima de la superficie del líquido sin perturbar, es despreciable.
No todos los laboratorios escolares disponen de un anillo para realizar la medida de la tensión superficial de un líquido, pero si disponen de portaobjetos para microscopio. Se trata de una pequeño pieza rectangular de vidrio cuyas dimensiones son a=75 mm de largo, b=25 mm de ancho y aproximadamente c=1 mm de espesor, su peso es aproximadamente 4.37 g.

Se pesa primero el portaobjetos en el aire y a continuación, cuando su borde inferior toca la superficie del líquido. La diferencia de peso ΔF está relacionada con la tensión superficial
ΔF=2·γ(a+c)
Se empuja el portaobjetos hacia arriba cuasiestáticamente. Justamente, cuando va a dejar de tener contacto con la superficie del líquido, la fuerza F que hemos de ejercer hacia arriba es igual a la suma de:
- El peso del portaobjetos mg
- La fuerza debida a la tensión superficial de la lámina de líquido que se ha formado 2·γ(a+c)
- El peso del líquido ρgach que se ha elevado una altura h, sobre la superficie libre de líquido. Siendo ρ es la densidad del líquido.
Para un portaobjetos de la dimensiones señaladas, que toca la superficie del agua, h es del orden de 2.3 mm (véase el artículo citado en las referencias)
- La fuerza debida a la tensión superficial es 2·γ(a+c)=2·72.8·10-3·(0.075+0.001)=11.07·10-3 N
- El peso de la lámina de agua es del orden de ρgach=1000·9.8·0.075·0.001·0.0023=1.70·10-3 N
Para que la simulación sea lo más simple posible, no se ha tenido en cuenta el peso de la lámina de líquido que se eleva por encima de la superficie libre.
Actividades
El programa interactivo genera aleatoriamente el peso de un portaobjetos entre ciertos límites.
Se pulsa el botón titulado Nuevo
-
Se pesa el portaobjetos en el aire, arrastrando con el puntero del ratón las flechas de color azul, rojo y negro, que marcan los gramos, décimas y centésimas de gramo respectivamente.
-
Se elige el líquido en el control de selección titulado Líquidos
Se pulsa el botón titulado Medir
-
Se pesa el portaobjetos cuya parte inferior toca la superficie del líquido
Se calcula la diferencia ΔF entre ambos pesos
Se calcula la tensión superficial γ a partir de la fórmula
ΔF=2·γ(a+c)
donde a=75 mm y c=1 mm
Se compara el valor calculado, con el proporcionado por el programa interactivo pulsando el botón titulado Respuesta.
Ejemplo:
Se pesa el portaobjetos en el aire, 4.27 g
Se pesa el portaobjetos cuando toca la superficie del líquido 5.39 g
Calculamos la diferencia de los dos pesos en N
ΔF=(5.39-4.27)·9.8/1000=10.98·10-3 N
Se despeja la tensión superficial
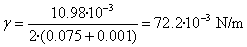
El programa interactivo genera aleatoriamente el peso de un portaobjetos entre ciertos límites.
Se pulsa el botón titulado Nuevo
- Se pesa el portaobjetos en el aire, arrastrando con el puntero del ratón las flechas de color azul, rojo y negro, que marcan los gramos, décimas y centésimas de gramo respectivamente.
- Se elige el líquido en el control de selección titulado Líquidos
Se pulsa el botón titulado Medir
- Se pesa el portaobjetos cuya parte inferior toca la superficie del líquido
Se calcula la diferencia ΔF entre ambos pesos
Se calcula la tensión superficial γ a partir de la fórmula
ΔF=2·γ(a+c)
donde a=75 mm y c=1 mm
Se compara el valor calculado, con el proporcionado por el programa interactivo pulsando el botón titulado Respuesta.
Ejemplo:
Se pesa el portaobjetos en el aire, 4.27 g
Se pesa el portaobjetos cuando toca la superficie del líquido 5.39 g
Calculamos la diferencia de los dos pesos en N
ΔF=(5.39-4.27)·9.8/1000=10.98·10-3 N
Se despeja la tensión superficial
No hay comentarios:
Publicar un comentario